| Guía de práctica clínica de la ESC para el manejo del infarto agudo de miocardio en pacientes con elevación del segmento ST | 您所在的位置:网站首页 › R Guía de Práctica Clínica Ataque cerebrovascular › Guía de práctica clínica de la ESC para el manejo del infarto agudo de miocardio en pacientes con elevación del segmento ST |
Guía de práctica clínica de la ESC para el manejo del infarto agudo de miocardio en pacientes con elevación del segmento ST
|
ATENCIÓN EN URGENCIASDiagnóstico inicial El manejo del IAM —incluido el diagnóstico y el tratamiento— empieza en el lugar donde se produce el primer contacto médico (PCM), definido como el punto en el que el personal médico o paramédico, u otro personal médico en el contexto prehospitalario, evalua al paciente incialmente o cuando llega a urgencias (normalmente, en un contexto ambulatorio)15. En primer lugar debe hacerse el diagnóstico de trabajo de infarto de miocardio. Este diagnóstico se suele basar en una historia de dolor torácico de 20min de duración o más que no responde a la nitroglicerina. Algunas claves importantes son una historia de cardiopatía isquémica y la irradiación del dolor hacia el cuello, la mandíbula o el brazo izquierdo. El dolor puede no ser agudo. Algunos pacientes presentan síntomas menos típicos, como náuseas/vómitos, disnea, fatiga, palpitaciones o síncope. Estos pacientes suelen presentarse más tarde, con más frecuencia se trata de mujeres, diabéticos o pacientes ancianos, y reciben con menor frecuencia terapia de reperfusión y otros tratamientos basados en la evidencia que los pacientes con una presentación típica de dolor torácico. Los registros muestran que hasta un 30% de pacientes con IAMCEST se presenta con sínt omas atípicos 16. Te ner conciencia de es tas presentaciones atípicas y el acceso fácil a la angiografía aguda para el diagnóstico precoz puede mejorar el resultado clínico en este grupo de alto riesgo. Un diagnóstico a tiempo de IAMCEST es la clave para el éxito en su manejo. La monitorización ECG debe iniciarse lo antes posible en todos los pacientes con sospecha de IAMCEST, para detectar arritmias que pongan en riesgo la vida y permitir la desfibrilación inmediata cuando esté indicada. Se debe realizar un ECG de 12 derivaciones e interpretarlo lo antes posible en el punto del PCM (tabla 4)17. Incluso en una fase temprana, el ECG es raramente normal. Típicamente se debe encontrar una elevación del segmento ST en el IAM, medido en el punto J, en 2 derivaciones contiguas y debe ser ≥ 0,25mV en varones de menos de 40 años de edad, ≥ 0,2mV en varones de más de 40 años o ≥ 0,15mV en mujeres en las derivaciones V2-V3 o ≥ 0,1mV en otras derivaciones (en ausencia de hipertrofia del ventrículo izquierdo [VI] o bloqueo de rama)2. En pacientes con infarto de miocardio inferior es recomendable registrar derivaciones precordiales derechas (V3R y V4R) para buscar la elevación ST, con el fin de identificar infarto ventricular derecho concomitante2,18. De forma similar, la depresión del segmento ST en las derivaciones V1-V3 sugiere isquemia miocárdica, sobre todo cuando la onda T terminal es positiva (equivalente a la elevación ST), y se puede confirmar por una elevación ST concomitante ≥ 0,1mV registrada en las derivaciones V7-V92. Tabla 4.Recomendaciones para el diagnóstico inicial Recomendaciones Clasea Nivelb Referencias Se debe obtener un ECG de 12 derivaciones lo antes posible en el lugar del primer contacto médico, con un objetivo de retraso ≤ 10 min I B 17,19 La monitorización ECG se debe iniciar lo antes posible en todos los pacientes con sospecha de IAMCEST I B 20,21 Se recomienda tomar muestra de sangre de forma rutinaria para determinación de marcadores séricos en la fase aguda, pero no hay que esperar a los resultados para iniciar el tratamiento de reperfusión I C Se debe considerar el uso de derivaciones torácicas posteriores adicionales (V7-V9 ≥ 0,05 mV) en pacientes con alta sospecha de infarto de miocardio inferobasal (oclusión de la circunfleja) IIa C La ecocardiografía debe ayudar al diagnóstico en los casos dudosos, pero no debe retrasar el traslado a angiografía IIb CECG: electrocardiograma; IAMCEST: infarto agudo de miocardio con elevación del segmento ST. aClase de recomendación. bNivel de evidencia. El diagnóstico ECG puede ser más difícil en algunos casos (tabla 5) que, no obstante, requieren un manejo inmediato. Tabla 5.Presentaciones del electrocardiograma atípicas que requieren un manejo rápido en pacientes con signos y síntomas de isquemia miocárdica en curso Bloqueo de rama izquierda Ritmo ventricular estimulado Pacientes sin elevación diagnóstica del segmento ST pero con síntomas isquémicos persistentes Infarto de miocardio posterior aislado Elevación del segmento ST en la derivación aVREntre éstos: •Bloqueo de rama: en presencia de bloqueo de rama, el diagnóstico ECG de IAM es difícil, pero a menudo posible cuando hay anomalías ST importantes. Se han propuesto algunos algoritmos algo complejos para ayudar al diagnóstico22, pero no proporcionan certeza diagnóstica23. La presencia de elevación ST concordante (es decir, en derivaciones con desviaciones QRS positivas) parece ser uno de los mejores indicadores de infarto de miocardio en curso con una arteria ocluida24. Los datos previos de los ensayos sobre trombolisis han demostrado que la terapia de reperfusión es beneficiosa en pacientes con bloqueo de rama y sospecha de infarto de miocardio. Sin embargo, la mayoría de pacientes con bloqueo de rama evaluados en urgencias no tiene una oclusión coronaria aguda, ni requiere angioplastia primaria. Un ECG previo puede ayudar a determinar si el bloqueo de rama es nuevo (y, por lo tanto, la sospecha de infarto de miocardio en curso es alta). Es importante indicar que, en los pacientes con sospecha clínica de isquemia miocárdica con bloqueo de rama nuevo o presuntamente nuevo, se debe considerar la terapia de reperfusión de forma precoz, preferiblemente mediante angiografía coronaria de urgencias con angioplastia primaria o, si no está disponible, trombolisis intravenosa. Un test de troponina positivo en el punto de atención, 1-2 h después del inicio de los síntomas en pacientes con bloqueo de rama de origen incierto, puede ayudar a decidir la conveniencia de realizar una angiografía de urgencias con angioplastia primaria. Los pacientes con infarto de miocardio y bloqueo de rama derecha también tienen un pronóstico pobre25, aunque el bloqueo de rama derecha normalmente no va a interferir en la interpretación de la elevación del segmento ST. El manejo precoz debe considerarse cuando se produzcan síntomas isquémicos persistentes en presencia de bloqueo de rama derecha, independientemente de que su existencia se conociera de antemano. •El ritmo de marcapasos ventricular también puede interferir en la interpretación de los cambios del segmento ST y puede requerir una angiografía urgente para confirmar el diagnóstico e iniciar el tratamiento. Se puede considerar la reprogramación del marcapasos — para permitir la evaluación de los cambios del ECG durante el ritmo cardiaco intrínseco— en pacientes que no son dependientes de la estimulación ventricular, sin retrasar el estudio invasivo. •Pacientes sin ECG diagnóstico: algunos pacientes con oclusión coronaria aguda pueden tener un ECG inicial sin elevación del segmento ST, a veces debido a que se les explora de forma muy precoz después del inicio de los síntomas (en estos casos hay que buscar ondas T hiperagudas, que pueden preceder a la elevación del segmento ST). Es importante repetir el ECG o monitorizar el segmento ST. Además, existe la preocupación de que algunos pacientes con oclusión aguda genuina de una arteria coronaria e infarto de miocardio en curso (como aquellos con arteria circunfleja ocluida26,27, oclusión aguda de un injerto venoso o enfermedad del tronco principal), puedan presentarse sin elevación del segmento ST y se les niegue la terapia de reperfusión, lo que acaba por producir infartos más extensos y un peor resultado clínico. Extender el ECG estándar de 12 derivaciones con derivaciones V7-V9, aunque puede ser útil, no siempre identifica a estos pacientes. En cualquier caso, la sospecha de isquemia miocárdica —a pesar del tratamiento médico— es una indicación para angiografía coronaria de urgencias con revascularización, incluso en pacientes sin elevación diagnóstica del segmento ST3. •Infarto de miocardio posterior aislado: el IAM de la porción inferobasal del corazón, que a menudo corresponde al territorio de la circunfleja, en el que el principal hallazgo es la depresión aislada del segmento ST de ≥ 0,05mV en las derivaciones V1-V3, debe tratarse como un IAMCEST. Está recomendado el uso de derivaciones adicionales torácicas posteriores (V7-V9 ≥ 0,05mV [≥ 0,1mV en varones •Obstrucción de la descendente anterior-elevación de la derivación aVR ST y depresión ST inferolateral: la presencia de depresión ST > 0,1mV en 8 o más derivaciones de superficie, unido a elevación ST en aVR o V1 en ausencia de otros cambios en el ECG, sugiere isquemia debida a obstrucción de la coronaria izquierda principal o multivaso, especialmente si el paciente presenta compromiso hemodinámico28 En pacientes con sospecha de isquemia miocárdica y elevación del segmento ST o bloqueo de rama izquierda nueva o presuntamente nueva, se debe iniciar terapia de reperfusión lo antes posible. No obstante, el ECG puede ser equívoco en las primeras horas e, incluso cuando hay infarto probado, puede no mostrar nunca las características típicas de la elevación del segmento ST y ondas Q nuevas. Si el ECG es equívoco o no muestra ninguna evidencia que apoye la sospecha clínica de infarto de miocardio, los ECG deben repetirse y, cuando sea posible, el ECG actual debe compararse con los registros previos. Puede ser de ayuda realizar registros de, por ejemplo, las derivaciones V7, V8 y V9 para el diagnóstico de casos seleccionados. En la fase aguda se realiza de forma rutinaria la extracción de sangre para marcadores séricos, pero no se debe esperar a los resultados para iniciar el tratamiento de reperfusión. La troponina (T o I) es el biomarcador de elección, debido a su alta sensibilidad y especificidad para la necrosis miocárdica. En pacientes que tienen una probabilidad clínica baja o intermedia de isquemia miocárdica en evolución y una duración prolongada de los síntomas previos, un test negativo de troponina puede ayudar a evitar una angiografía de urgencias, innecesaria en algunos pacientes Si hay dudas sobre la posibilidad de que haya un infarto de miocardio en evolución, la prueba de imagen de urgencias (en lugar de esperar a que los biomarcadores estén elevados) permite la indicación de una terapia de reperfusión a tiempo en estos pacientes. Cuando se encuentra disponible de forma local, la angiografía coronaria de urgencias es la modalidad de elección, ya que puede ir seguida inmediatamente de una angioplastia primaria en caso de que el diagnóstico se confirme. En hospitales o centros en los que la angiografía coronaria no se encuentre disponible de forma inmediata —y siempre que no suponga un retraso en el traslado— la confirmación rápida de las anomalías segmentarias en la motilidad de la pared mediante ecocardiografía de 2 dimensiones (2D) puede ayudar a tomar la decisión de traslado de urgencia a un centro con capacidad para realizar angioplastia, ya que las anomalías regionales de la motilidad de la pared se producen en los primeros minutos después de la oclusión coronaria, bastante antes de la necrosis. Sin embargo, las anomalías de la motilidad de la pared no son específicas del IAM y pueden deberse a otras causas como isquemia, un infarto antiguo o defectos de la conducción ventricular. La ecocardiografía 2D es especialmente útil en el diagnóstico de otras causas de dolor torácico, como el derrame pericárdico, la embolia pulmonar masiva o la disección de la aorta ascendente (tabla 4). La ausencia de anomalías de la motilidad de la pared excluye uninfarto de miocardio importante. En urgencias, el papel de la evaluación por tomografía computarizada debe restringirse a diagnósticos diferenciales de disección aórtica aguda o embolia pulmonar. La miocardiopatía inducida por estrés (tako-tsubo) es un síndrome recientemente reconocido que puede ser difícil de diferenciar del IAMCEST, ya que los síntomas y los hallazgos clínicos, que varían desde un dolor torácico leve a un shock cardiogénico, puede simular un IAM, pero los cambios electrocardiográficos en la presentación suelen ser modestos y no se correlacionan con la gravedad de la disfunción ventricular. Se suele desencadenar por un estrés físico o emocional, y se caracteriza en su forma típica por una dilatación transitoria del VI apical o medial y disfunción. Debido a que no hay ninguna prueba específica para descartar un infarto de miocardio en este contexto, no se debe retrasar la angiografía de urgencia y, en ausencia de infarto de miocardio, mostrará ausencia de estenosis significativa de la arteria coronaria responsable o trombos intracoronarios. El diagnóstico se confirma por el hallazgo, en la prueba de imagen, de discinesia transitoria apical a medioventricular con hipercinesia compensatoria basal, y por la presencia de valores plasmáticos desproporcionadamente bajos de biomarcadores cardiacos en relación con la gravedad de la disfunción ventricular y, finalmente, por la recuperación de la función VI29. Alivio del dolor, disnea y ansiedadEl alivio del dolor es de extrema importancia, no sólo por razones humanitarias sino también porque el dolor se asocia a activación simpática que causa vasoconstricción y aumenta el trabajo cardiaco. Los analgésicos más utilizados en este contexto son los opiáceos intravenosos (i.v.) titulados (p. ej., morfina) (tabla 6). Se deben evitar las Tabla 6.Recomendaciones para el alivio del dolor, la disnea y la ansiedad Recomendaciones Clasea Nivelb Están indicados los opiáceos titulados i.v. para aliviar el dolor I C Está indicado el uso de oxígeno en pacientes con hipoxia (SaO2 I C Se puede considerar la administración de tranquilizantes en pacientes con mucha ansiedad IIa Ci.v.: intravenoso; SaO2: saturación de oxígeno. aClase de recomendación. bNivel de evidencia. inyecciones intramusculares. Pueden ser necesarias dosis repetidas. Los efectos secundarios incluyen náuseas y vómitos, hipotensión, bradicardia y depresión respiratoria. Se pueden administrar antieméticos simultáneamente para reducir las náuseas. La hipotensión y la bradicardia suelen responder a la atropina y la depresión respiratoria a la naloxona (0,1-0,2mg i.v. cada 15min cuando esté indicado), que deben encontrarse siempre disponibles. Se debe administrar oxígeno (mediante mascarilla o gafas nasales) a los pacientes que tengan disnea, que estén hipóxicos o a los que tengan insuficiencia cardiaca. Sigue siendo controvertido si es conveniente administrar oxígeno sistemáticamente a los pacientes sin insuficiencia cardiaca o disnea30. Es de gran ayuda la monitorización no invasiva de la saturación de oxígeno a la hora de decidir la necesidad de administrar oxígeno o asistencia respiratoria. La ansiedad es una respuesta natural al dolor y las circunstancias que envuelven a un ataque cardiaco. Es fundamental dar seguridad a los pacientes y a las personas que se encuentran próximas. Si el paciente se encuentra demasiado trastornado puede ser adecuado administrarle un tranquilizante, aunque los opiáceos suelen ser suficientes. Paro cardiacoMuchas muertes ocurren precozmente durante las primeras horas después de un IAMCEST debido a fibrilación ventricular (FV). Como esta arritmia ocurre, sobre todo, en una fase temprana, estas muertes suelen tener lugar fuera del hospital. Por lo tanto es crucial que todo el personal médico y paramédico que se ocupa de los casos en los que hay sospecha de infarto de miocardio tengan acceso a desfibriladores y estén entrenados para las medidas de soporte vital cardiaco, y que se realice una monitorización ECG inmediata, en el lugar donde se produce el PCM, en todos los pacientes con sospecha de infarto de miocardio (tabla 7). Tabla 7.Paro cardiaco Recomendaciones Clasea Nivelb Referencias Todo el personal médico y paramédico que atienda a un paciente con sospecha de infarto de miocardio debe tener acceso a un desfibrilador y debe estar entrenado en técnicas de soporte vital cardiaco I C – Se recomienda iniciar monitorización ECG en el lugar del primer contacto médico en todos los pacientes con sospecha de infarto de miocardio I C – Está indicada la hipotermia terapéutica de forma precoz después de la reanimación en pacientes con paro cardiaco que estén en coma o profundamente sedados I B 34–36 Se recomienda angiografía inmediata con posibilidad de angioplastia primaria en pacientes reanimados de paro cardiaco en los que el ECG muestre IAMCEST I B 31–33 Se debe considerar angiografía con posibilidad de angioplastia primaria en los supervivientes de un paro cardiaco que no tengan una elevación ECG diagnóstica del segmento ST pero con alta sospecha de infarto en curso IIa B 31–33ECG: electrocardiograma; IAMCEST: infarto agudo de miocardio con elevación del segmento ST aClase de recomendación. bNivel de evidencia En pacientes reanimados de paro cardiaco, en los que el ECG muestra elevación del segmento ST, la estrategia de elección es la angiografía inmediata con posibilidad de angioplastia primaria, siempre que se puedan cumplir los plazos de tiempo indicados en las guías31–33. Debido a la alta prevalencia de oclusiones coronarias y a las dificultades potenciales a la hora de interpretar el ECG en pacientes que han tenido paro cardiaco, se debe considerar la angiografía inmediata en los supervivientes de un paro cardiaco que tengan un índice elevado de sospecha de infarto en curso (presencia de dolor torácico antes del paro cardiaco, historia de cardiopatía isquémica establecida y anomalías en el ECG o resultados del ECG inciertos)31–33. Además, hay evidencias de que los supervivientes de paro cardiaco sufrido fuera del hospital que están en estado comatoso tienen mejores resultados clínicos neurológicos cuando se aplica frío de forma precoz tras la reanimación. Por lo tanto, estos pacientes deben recibir rápidamente hipotermia terapéutica34–36. No está clara cuál debe ser la secuencia óptima de enfriamiento y angioplastia primaria en estos pacientes. La utilización de protocolos locales/regionales de manejo óptimo del paro cardiaco que tiene lugar fuera del hospital es fundamental para proporcionar una reanimación cardiopulmonar rápida, desfribrilación precoz (si es necesaria) y soporte vital avanzado efectivo. La disponibilidad de desfibriladores automáticos externos es un factor clave para aumentar la supervivencia. La prevención y los tratamientos mejorados del paro cardiaco que ocurre fuera del hospital son esenciales para reducir la mortalidad relacionada con la cardiopatía isquémica. Para una discusión más detallada de estos aspectos véanse las recientes guías para la reanimación del European Resuscitation Council37. Logística de atención prehospitalariaRetrasosLa prevención de los retrasos es crítica en el IAMCEST por 2 razones: la primera, porque el momento más crítico de un infarto de miocardio es su fase más inicial, durante la cual los pacientes suelen experimentar dolor intenso y pueden sufrir paro cardiaco. Se debe conseguir un desfibrilador para el paciente con sospecha de IAM lo antes posible para poder realizar una desfribrilación inmediata si es necesario. Además, la disponibilidad precoz de un tratamiento, especialmente de la terapia de reperfusión, es crítica para aumentar los beneficios obtenidos38. Por lo tanto, minimizar cualquier retraso se asocia a mejores resultados clí-nicos. Además, los retrasos en el tratamiento representan el índice de calidad asistencial más fácil de cuantificar en el IAMCEST; se deberían registrar en todos los hospitales que atienden a pacientes con IAMCEST y se deben monitorizar regularmente para asegurar el cumplimiento y el mantenimiento a lo largo del tiempo de indicadores simples de calidad asistencial. Aunque este aspecto sigue siendo controvertido, la información pública de los retrasos puede ser una forma útil de estimular la mejoría en la atención de los pacientes con IAMCEST. Cuando no se alcancen los objetivos será necesario aplicar intervenciones para mejorar la actuación. Hay varios componentes en el retraso de la atención en el IAMCEST y diversas formas de registrarlos y hacerlos públicos. Para simplificar se aconseja describir e informar de los retrasos tal como se muestra en la figura 1. •Retraso del paciente: se refiere al retraso entre el inicio de los síntomas y el PCM. Para minimizar el retraso del paciente, el público debe saber cómo reconocer los síntomas comunes de un IAM y cómo llamar al servicio de urgencias, aunque la efectividad de las campañas públicas todavía no se ha establecido claramente38. Los pacientes con historia de cardiopatía isquémica y sus familias deben recibir información acerca de cómo reconocer los síntomas debidos a IAM y los pasos prácticos que deben seguir, en caso de que se produzca sospecha de síndrome coronario agudo (SCA). Puede ser útil proporcionar a los pacientes con cardiopatía isquémica estable unacopia de su ECG basal de rutina para que el personal médico pueda hacer comparaciones. •Retraso entre el primer contacto médico y el diagnóstico: un buen índice de la calidad asistencial es el tiempo transcurrido para registrar el primer ECG. En los hospitales y servicios médicos de urgencias que participan en la atención de los pacientes con IAMCEST, el objetivo debe ser reducir este retraso a 10min o menos. •Retraso entre el primer contacto médico y la terapia de reperfusión: esto se conoce como el «retraso del sistema». Es más susceptible de modificarse a partir de medidas de tipo organizativo que el retraso del paciente. Es un indicador de la calidad asistencial y un predictor del resultado clínico39. Si la terapia de reperfusión es angioplastia primaria, el objetivo debe ser un retraso (desde el PCM hasta la introducción de la guía en la arteria responsable) de ≤ 90min (y, en casos de alto riesgo con infarto anterior extenso que se presentan precozmente dentro de las primeras 2 h debe ser ≤ 60 min)40,41. Si la terapia de reperfusión es fibrinolisis, el objetivo debe ser reducir este retraso (desde el PCM hasta la inyección) a ≤ 30min. •En hospitales con capacidad para realizar ICP, el objetivo debe ser alcanzar un retraso «puerta-balón» de ≤ 60min entre la llegada del paciente al hospital y la angioplastia primaria (definida como la introducción de la guía dentro de la arteria responsable). Este retraso refleja la organización y capacidad de actuación del hospital con capacidad para realizar angioplastias. •Desde la perspectiva del paciente, el retraso entre el inicio de los síntomas y la terapia de reperfusión (ya sea el inicio de la fibrinolisis o la introducción del catéter en la arteria responsable) es, quizá, el aspecto más importante, puesto que refleja el tiempo isquémico total. Debe reducirse todo lo que sea posible. 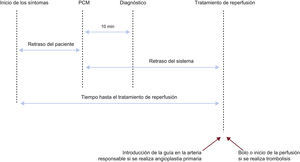 Figura 1. Figura 1. Componentes del retraso en el infarto agudo de miocardio con elevación del segmento ST e intervalos ideales para la intervención. PCM: primer contacto médico. Todos los retrasos están relacionados con el primer contacto médico. (0,22MB). Sistema médico de urgenciasEs importante disponer de un sistema médico de urgencias con un único número telefónico fácil de recordar y bien publicitado para cubrir las urgencias médicas y evitar los retrasos en el transporte. Sería ideal tener un sistema de teleconsulta entre el servicio de urgencias y un centro cardiológico de referencia, aunque este sistema sólo se encuentra operativo en un número limitado de países. Por lo tanto es muy importante disponer de un servicio de urgencias bien entrenado y un protocolo escrito, actualizado y compartido, sobre manejo del IAMCEST. A pesar de que los servicios de urgencias reducen el retraso y son la forma preferida de atención sanitaria inicial en pacientes con sospecha de IAMCEST, están infrautilizados en muchos países y, a menudo, los pacientes se presentan por sí mismos al servicio de urgencias. El servicio de ambulancias desempeña un papel crítico en el manejo del IAM y debe considerarse no sólo una forma de transporte sino también el lugar donde se produce el diagnóstico inicial, la selección y el tratamiento. Se ha demostrado que el diagnóstico prehospitalario, la selección y el tratamiento de urgencias inicial se asocia a un mayor uso de las terapias de reperfusión, reducción de los retrasos y mejora en los resultados clínicos39,42. Además, el transporte en ambulancia permite el diagnóstico y tratamiento del paro cardiaco. La calidad de la atención depende del entrenamiento del personal responsable. Todo el personal de las ambulancias debe estar entrenado para reconocer los síntomas de un IAM, administrar oxígeno, aliviar el dolor y proporcionar soporte vital básico (tabla 8). Todas las ambulancias de urgencias deben estar equipadas con sistemas de monitorización de ECG, desfibriladores y, por lo menos, una de las personas de la ambulancia debe estar entrenada en técnicas avanzadas de soporte vital. Hay evidencias que indican que el personal paramédico adecuadamente entrenado puede identificar de forma efectiva a los pacientes con IAM y proporcionar reperfusión a tiempo, y que las ambulancias con personal médico —que sólo están disponibles en algunos países— no son necesarias para el manejo prehospitalario efectivo del IAM43. El personal paramédico entrenado para administrar trombolíticos puede hacerlo de forma segura y efectiva. Como la trombolisis prehospitalaria es una opción terapéutica atractiva en pacientes que se presentan de forma precoz tras el inicio de los síntomas, especialmente cuando el tiempo de traslado es largo40,44,45, está recomendado un entrenamiento continuo del personal paramédico para realizar estas funciones, incluso en la era de la angioplastia primaria. En regiones específicas, los sistemas de ambulancia aéreos pueden reducir aún más los retrasos en el transporte y mejorar los resultados clínicos46. El personal de la ambulancia debe ser capaz de registrar un ECG con fines diagnósticos e interpretarlo o transmitirlo para que pueda revisarlo personal con experiencia en la unidad coronaria o en otro sitio. El registro, la interpretación y, en ocasiones, la teletransmisión de un ECG antes del ingreso hospitalario puede acelerar, en gran medida, el manejo hospitalario y aumentar la probabilidad de realizar una terapia de reperfusión a tiempo. Tabla 8.Logística de la atención prehospitalaria Recomendaciones Clasea Nivelb Referencias El personal de la ambulancia debe estar entrenado y equipado para identificar un IAMCEST (usando registros ECG y telemetría según sea necesario) y para administrar el tratamiento inicial, incluida la trombolisis cuando sea necesaria I B 43 El manejo prehospitalario de los pacientes con IAMCEST debe basarse en redes regionales diseñadas para proporcionar tratamiento de reperfusión de forma expeditiva y efectiva, y se debe hacer un esfuerzo para que la angioplastia primaria esté disponible en el mayor número posible de pacientes I B 47 Los centros con capacidad para realizar angioplastias primarias deben ofrecer un servicio 24/7 y ser capaces de iniciar una angioplastia primaria lo antes posible, pero siempre dentro de los primeros 60 min después de la llamada inicial I B 6,52,55 Todos los hospitales y servicios de urgencias que participen en la atención de pacientes con IAMCEST deben registrar y monitorizar el tiempo de retraso, y trabajar para alcanzar y mantener los siguientes objetivos de calidad:• Desde el primer contacto médico al primer ECG ≤ 10 min• Desde el primer contacto médico al tratamiento de reperfusión• Para fibrinolisis ≤ 30min• Para angioplastia primaria ≤ 90 min (≤ 60 min si el paciente se presenta en los primeros 120 min desde el inicio de los síntomas o directamente a un centro con capacidad para realizar ICP) I B 56,57 Todos los sistemas médicos de urgencias y las unidades coronarias deben tener un protocolo escrito actualizado de manejo del IAMCEST, preferiblemente compartido dentro de las redes geográficas I C Los pacientes que se presentan en un hospital sin capacidad de ICP y que esperan el traslado a un centro para angioplastia primaria o de rescate, deben ser atendidos en un área adecuadamente monitorizada I C Los pacientes que son trasladados a un centro con capacidad de ICP para angioplastia primaria, deben evitar pasar por el servicio de urgencias y transferirse directamente al laboratorio de hemodinámica IIa B 41,50,58ECG: electrocardiograma; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; 24/7: 24 h al día, 7 días a la semana. aClase de recomendación. bNivel de evidencia. RedesEl tratamiento óptimo del IAMCEST debe basarse en la utilización de redes entre hospitales con varios niveles de tecnología conectados por un servicio eficiente de ambulancias. El objetivo de estas redes es proporcionar una atención médica óptima y reducir los retrasos, con el objeto de mejorar los resultados clínicos. Los cardiólogos —y, sobre todo, los médicos de urgencias— deben colaborar activamente con todos los agentes económicos a la hora de establecer estas redes. Sus principales características son: •Definición clara de las áreas geográficas de responsabilidad. •Protocolos compartidos, basados en la estratificación del riesgo y el transporte por personal paramédico entrenado en ambulancias adecuadamente equipadas o helicópteros. •Selección prehospitalaria de los pacientes con IAMCEST para su destino a las instituciones adecuadas, evitando los hospitales sin capacidad para realizar angioplastia, siempre que la angioplastia primaria se pueda realizar dentro de los límites de tiempo recomendados. •A su llegada al hospital de destino, el paciente debe ser trasladado inmediatamente al laboratorio de hemodinámica, sin pasar porel servicio de urgencias. •Los pacientes que se presenten en un hospital sin capacidad para realizar angioplastia y que estén esperando el transporte para angioplastia primaria o de rescate tienen que ser atendidos en un área adecuadamente monitorizada y con el personal apropiado. •Si el diagnóstico de IAMCEST no se ha realizado en la ambulancia y esta llega a un hospital sin capacidad para realizar angioplastia, la ambulancia debe esperar el diagnóstico y, si se confirma el IAMCEST, debe continuar hasta un hospital con capacidad para realizar angioplastia. Para maximizar la experiencia del personal, los centros con angioplastia primaria deben llevar a cabo los procedimientos de forma sistemática durante las 24 h/7 días a la semana (24/7) para todos los pacientes con IAMCEST. Hay otros modelos, que no son ideales, y que incluyen rotaciones semanales o diarias de centros con angioplastia primaria o múltiples centros con capacidad para angioplastia primaria dentro de la misma región. Se debería permitir que los hospitales que no pueden ofrecer un servicio 24/7 para angioplastia primaria realicen angioplastia primaria en pacientes ingresados por otra causa y que desarrollan IAMCEST durante el ingreso. No obstante, estos hospitales no deberían ofrecer un servicio limitado al horario diurno —o dentro de las primeras horas—, ya que esto genera confusión entre los operadores responsables del servicio de urgencias, y es poco probable que se cumplan los requisitos de tiempo «puerta-balón» y los criterios de calidad en la intervención que se cumplen en los verdaderos centros de angioplastia primaria especializados en el servicio 24/7. La población de referencia actual de los sistemas de redes en los países europeos que ofrecen angioplastia primaria a la mayor parte de su población es de 0,3-1,0 millones6. En áreas de servicios pequeños, la experiencia puede ser subóptima debido a un número insuficiente de pacientes con IAMCEST. Sin embargo, no está claro cuál debe ser el tamaño óptimo del área de referencia. Las áreas geográficas en las que el tiempo esperado de traslado a un centro con angioplastia primaria no permite alcanzar el retraso máximo permitido indicado en las recomendaciones que vienen más abajo (v. sección 3.4.6.) tienen que desarrollar sistemas de trombolisis rápida, preferiblemente en la ambulancia/fuera del hospital, seguido de transferencia inmediata a centros con angioplastia primaria. Este tipo de redes reduce los retrasos en el tratamiento y aumenta la proporción de pacientes que reciben reperfusión47–49. En cada red se debe cuantificar y comparar a intervalos regulares la calidad de la asistencia, el tiempo que se tarda en recibirla y los resultados clínicos del paciente, y se deben tomar las medidas adecuadas para mejorar estos parámetros. En un gran registro de Estados Unidos, diversas estrategias se asociaron a una reducción del retraso en la angioplastia primaria, como la capacidad para activar el laboratorio de hemodinámica con una sola llamada, preferiblemente mientras el paciente se encuentra de camino hacia el hospital, con la intención de que el personal que va a realizar el cateterismo llegue al laboratorio de hemodinámica dentro de un plazo de 20min tras haber contactado por el busca, teniendo al cardiólogo en su puesto y utilizando un sistema de retroalimentación de datos a tiempo real entre la atención previa que ha recibido el paciente y el laboratorio de hemodinámica50. Las estrategias más efectivas para aumentar la proporción de pacientes que reciben una reperfusión efectiva y reducir los retrasos en la angioplastia primaria pueden ser diferentes en otros sistemas de salud. Con el objeto de abordar la cuestión del acceso a la angioplastia primaria y la utilización efectiva de las redes en toda Europa6, el grupo de trabajo de la ESC sobre atención cardiaca aguda (A cut e Car diac Car e), junto con la Eur opean Association of Percutaneous Cardiovascular Interventions y el EuroPCR, han unido sus fuerzas en la iniciativa Stent for Life para mejorar el acceso a una angioplastia primaria a tiempo y efectiva a través de la implementación de programas específicos, hechos a la medida de cada sistema sanitario e intentando aprender a partir de las estrategias más exitosas51. La experiencia adquirida a través de esta iniciativa en diversos sistemas de atención sanitaria europeos se publica regularmente y proporciona los trucos y recursos necesarios para aumentar y mejorar la implementación de la angioplastia primaria (www.stentforlife.com)52. Médicos de cabeceraEn algunos países, los médicos de cabecera desempeñan un papel fundamental en la atención precoz del IAM y, a menudo, son los primeros a los que acude el paciente. Si los médicos de cabecera responden rápidamente pueden ser muy efectivos, ya que suelen conocer al paciente y pueden realizar e interpretar el ECG. La primera tarea después del diagnóstico ECG es alertar al servicio de urgencias. Pero también pueden administrar opiáceos y fármacos antitrombóticos (incluidos fibrinolíticos si ésa es la estrategia de manejo) y pueden realizar una desfibrilación cuando sea necesario. En la mayoría de casos, sin embargo, la consulta con un médico de cabecera —en lugar de llamar directamente al servicio de urgencias— aumenta el retraso prehospitalario. Por lo tanto, en general, se debe instruir al público para llamar al servicio de urgencias, antes que al médico de atención primaria, cuando haya síntomas que indiquen un infarto de miocardio. Procedimientos de admisiónEl manejo de los pacientes cuando llegan al hospital debe ser muy rápido, sobre todo en cuanto al diagnóstico y la administración de un fármaco fibrinolítico, o la realización de una angioplastia primaria, según la indicación. Los candidatos a angioplastia primaria deben ingresar directamente en el laboratorio de hemodinámica siempre que sea posible, sin pasar por el servicio de urgencias o la unidad coronaria, mientras que los candidatos a fibrinolisis tienen que tratarse directamente en el contexto prehospitalario, el servicio de urgencias o la unidad coronaria53,54. LogísticaEn una situación óptima (fig. 2), el paciente llama a un número central de urgencias para recibir ayuda lo antes posible después del inicio del dolor torácico. El servicio de urgencias envía una ambulancia completamente equipada con personal entrenado para realizar e interpretar un ECG de 12 derivaciones. Una vez que el ECG pone de manifiesto la elevación del segmento ST o un bloqueo de rama nuevo, o presuntamente nuevo, se informa al hospital más cercano con capacidad para realizar angioplastia acerca del tiempo estimado en el que va a llegar el paciente. Durante el traslado en la ambulancia, el laboratorio de hemodinámica se debe preparar y convocar al personal, cuando sea necesario, para que el paciente pueda ir directamente al laboratorio de cateterismo (sin pasar por el servicio de urgencias ni por la unidad coronaria). En los casos en los que el ECG diagnóstico se haya realizado en otro sitio (p. ej., un hospital sin capacidad para realizar angioplastia, un despacho médico, etc.), se debe llamar al servicio de urgencias para el traslado y seguir el procedimiento descrito anteriormente. Todo este proceso se lleva a cabo con más éxito cuando hay una red regional con un centro que realiza un gran volumen de angioplastias, varios hospitales circundantes que no practican angioplastia y un único servicio de urgencias regional. Este tipo de redes regionales debe disponer de protocolos de manejos predefinidos para pacientes con IAMCEST. 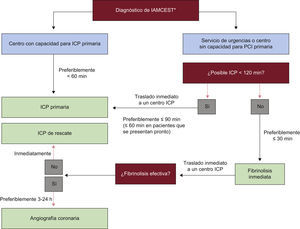 Figura 2. Figura 2. Manejo prehospitalario y hospitalario, y estrategias de reperfusión dentro de las primeras 24 h del primer contacto médico. IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea. *El momento en que el diagnostico se confirma a partir de la historia clínica y el electrocardiograma, idealmente dentro de los primeros 10 min después del primer contacto médico. Todos los retrasos están relacionados con el primer contacto médico. Adaptada de Wijns et al4. (0,37MB). Terapia de reperfusiónRestauración del flujo coronario y reperfusión del tejido miocárdicoEn pacientes con una presentación clínica de IAMCEST dentro de las primeras 12 h desde el inicio de los síntomas, y con elevación persistente del segmento ST o bloqueo de rama nuevo, o presuntamente nuevo, se debe realizar una reperfusión mecánica precoz o farmacológica lo antes posible (tabla 9). Tabla 9.Recomendaciones para el tratamiento de reperfusión Recomendaciones Clasea Nivelb Referencias La terapia de reperfusión está indicada en todos los pacientes con síntomas de I A 65,66 La terapia de reperfusión (preferiblemente angioplastia primaria) está indicada cuando hay evidencias de isquemia en curso, incluso cuando los síntomas se hayan iniciado > 12 h antes o cuando el dolor y los cambios del ECG hayan sido intermitentes I C 67 Se puede considerar el tratamiento de reperfusión con angioplastia primaria en pacientes estables que se presentan 12-24 h después del inicio de los síntomas IIb B 60,61 No está recomendado realizar ICP de rutina de una arteria totalmente ocluida > 24 h espués del inicio de los síntomas en pacientes estables que no presenten signos de isquemia (independientemente de que hayan recibido o no fibrinolisis) III A 62–64ECG: electrocardiograma; ICP: intervención coronaria percutánea. aClase de recomendación. bNivel de evidencia. Hay acuerdo general en que se debe considerar la terapia de reperfusión cuando haya evidencia clínica o ECG de isquemia en curso, incluso si, según el paciente, los síntomas se han iniciado > 12 h antes, ya que, a menudo, el inicio exacto de los síntomas no está claro, porque el dolor y los cambios del ECG son oscilantes59. No obstante, no hay consenso sobre si la angioplastia es también beneficiosa en pacientes que llevan > 12 h de evolución desde el inicio de los síntomas en ausencia de evidencia clínica o ECG de isquemia en curso. Un estudio aleatorizado pequeño (n = 347), realizado en este tipo de pacientes asintomáticos que llegan tarde, ha demostrado que se produce rescate miocárdico y mejoría de la supervivencia a los 4 años después de la angioplastia primaria, comparado con el tratamiento conservador solo, en pacientes con síntomas persistentes de 12-48 h de duración desde su inicio60,61. Sin embargo, en el gran estudio clínico (n = 2.166) OAT no se ha observado beneficio clínico después de una intervención coronaria de rutina y manejo médico en pacientes estables con oclusión persistente de la arteria responsable62,63, más allá del obtenido con manejo médico solamente, cuando la oclusión se identificaba 3-28 días después del IAM, incluyendo el subgrupo de 331 pacientes aleatorizados entre las 24 y 72 h después del inicio del infarto64. Un metaanálisis de los estudios clínicos, que ha probado si la recanalización tardía de una arteria coronaria es beneficiosa, ha demostrado resultados consistentes con los obtenidos en el estudio OAT51. Selección de una estrategia de reperfusiónLa angioplastia primaria —definida como una ICP urgente en el contexto de un IAMCEST, sin tratamiento fibrinolítico previo— es la estrategia de reperfusión preferida en pacientes con IAMCEST, siempre que se pueda realizar de forma rápida (es decir, dentro de los plazos de tiempo exigidos por las guías), por un equipo experimentado e independientemente de si el paciente se presenta a un hospital con capacidad para realizar angioplastias (fig. 1). Si el PCM se produce a través de un servicio de urgencias o en un centro sin capacidad para realizar angioplastias, se debe implementar de forma inmediata el traslado a través del servicio de urgencias hacia un laboratorio de hemodinámica para realizar la angioplastia. Un equipo experimentado no sólo requiere disponer de cardiólogos intervencionistas sino también de personal de apoyo capacitado. Esto significa que sólo los hospitales con un programa de cardiología intervencionista establecido (disponible las 24 h) deben usar angioplastia primaria como tratamiento de rutina. Se han observado tasas inferiores de mortalidad en pacientes que se someten a angioplastia primaria en centros con un alto volumen de procedimientos de angioplastia. La angioplastia primaria es efectiva para asegurar y mantener la permeabilidad coronaria evitándose algunos de los riesgos hemorrágicos de la fibrinolisis. Los estudios clínicos aleatorizados, que comparan la angioplastia primaria realizada a tiempo en un centro experimentado con un alto volumen de procedimientos con el tratamiento fibrinolítico llevado a cabo en el hospital, han demostrado repetidamente que la angioplastia primaria es superior a la fibrinolisis aplicada en el hospital68–71. (En estos estudios clínicos no hubo angioplastia de rescate en el seguimiento o angiografía de rutina en el seguimiento.) En los contextos clínicos en los que la angioplastia primaria no pueda realizarse dentro de los primeros 120min desde el PCM por un equipo experimentado se debe considerar la fibrinolisis, especialmente cuando pueda administrarse de forma prehospitalaria (p. ej., en la ambulancia)45,72,73 y dentro de los primeros 120min desde el inicio de los síntomas (fig. 2)40,74. La fibrinolisis debería ir seguida de una angioplastia de rescate o angiografía de rutina. Tanto los estudios clínicos aleatorizados como los registros han indicado que los retrasos importantes en la angioplastia primaria se asocian a peores resultados clínicos. El retraso en el tiempo de aplicación de la reperfusión se ha definido anteriormente en la sección 3.4.1. El «retraso relacionado con la angioplastia» es la diferencia teórica entre el tiempo desde el PCM hasta el inflado del balón, menos el tiempo desde el PCM hasta el inicio del tratamiento fibrinolítico (es decir, «puerta-a-balón» menos «puerta-a-aguja»). El grado en el cual el retraso relacionado con la angioplastia reduce las ventajas de la angioplastia sobre la fibrinolisis ha sido objeto de muchos análisis y debates. Debido a que ningún estudio clínico se ha diseñado específicamente para abordar esta cuestión, hay que tener precaución a la hora de interpretar los resultados de estos análisis post-hoc. A partir de los estudios clínicos aleatorizados, se ha calculado que el retraso relacionado con la angioplastia que puede mitigar el beneficio de la intervención mecánica varía entre 60 y 110min. En otro análisis de estos estudios clínicos se calculó que el beneficio de la angioplastia primaria sobre el tratamiento fibrinolítico se mantenía hasta un retraso relacionado con la angioplastia de 120 min66. En 192.509 pacientes incluidos en el registro norteamericano National Registry of Myocardial Infarction 2-441, el retraso medio relacionado con la angioplastia, en el que las tasas de mortalidad de las 2 estrategias de reperfusión fueron comparables, se calculó en 114min. Este estudio también indicó que este retraso variaba considerablemente según la edad, la duración de los síntomas y la localización del infarto: desde 65 años de edad que se presentaba > 2 h después del inicio de los síntomas. Aunque estos resultados fueron obtenidos a partir de un análisis post-hoc de un registro y, algunas veces, los tiempos calculados en los retrasos son poco precisos, este estudio sugiere que un enfoque individualizado para seleccionar la modalidad óptima de reperfusión, en lugar de uno uniforme, es más adecuado cuando la angioplastia primaria no puede realizarse de forma expeditiva. Teniendo en cuenta los estudios clínicos y los registros mencionados anteriormente, un objetivo para la evaluación de la calidad es que la angioplastia primaria (introducción de la guía) es que se realice dentro de los primeros 90min desde el PCM en todos los casos. En los pacientes que se presentan antes y que tienen una gran cantidad de miocardio en riesgo, el retraso debe ser menor ( min desde el PCM. Aunque no se han llevado a cabo estudios específicos, un objetivo que parece razonable es considerar un retraso máximo de sólo 90min después del PCM en estos pacientes. Conviene señalar que estos objetivos en el retraso para la implementación de la angioplastia primaria son indicadores de calidad y que pueden diferir del retraso máximo relacionado con la angioplastia de 120min, que es útil para seleccionar la angioplastia primaria sobre la fibrinolisis inmediata como la estrategia preferida de reperfusión (tabla 10).Tabla 10.Tiempos importantes de retraso y objetivos del tratamiento en el manejo del infarto agudo de miocardio con elevación del segmento ST Retraso Objetivo Preferido para ECG y diagnóstico desde el primer contacto médico ≤ 10 min Preferido para fibrinolisis desde el primer contacto médico (“primer contacto médico-aguja”) ≤ 30 min Preferido para angioplastia primaria desde el primer contacto médico (“puerta-balón”) en centros con ICP primaria ≤ 60 min Preferido para angioplastia primaria desde el primer contacto médico ≤ 90 min(≤ 60 min en pacientes que se presentan precozmente y tienen un área en riesgo extensa) Aceptable para ICP primaria más que para fibrinolisis ≤ 120 min(≤ 90 min en pacientes que se presentan precozmente y tienen un área en riesgo extensa). Si no se puede alcanzar este objetivo,considerar fibrinolisis Preferido para angiografía desde la fibrinolisis efectiva 3-24 hECG: electrocardiograma; ICP: intervención coronaria percutánea. Intervención coronaria percutánea primariaAspectos del procedimiento de la intervención coronaria percutánea primaria (tabla 11)Aproximadamente el 50% de los pacientes con IAMCEST tiene enfermedad multivaso significativa. Durante la intervención inicial sólo debe tratarse la arteria relacionada con el infarto (ARI). Actualmente no hay evidencias que apoyen una intervención urgente en las lesiones no relacionadas con el infarto75,76. Las únicas excepciones que justifican la angioplastia en múltiples vasos durante el IAMCEST corresponden a pacientes en shock cardiogénico que presentan múltiples estenosis muy críticas (≥ 90% diámetro) en lesiones altamente inestables (signos angiográficos de posibles trombos o rotura de la lesión) y cuando hay isquemia persistente de la lesión supuestamente responsable tras la angioplastia. No obstante, en pacientes con enfermedad multivaso y shock cardiogénico, no se deben colocar stents deforma rutinaria en las lesiones «no culpables» que no tengan estenosis críticas77 (v. también sección 3.5.4.9.). Tabla 11.Angioplastia primaria: indicaciones y aspectos del procedimiento Recomendaciones Clasea Nivelb Referencias Indicaciones para angioplastia primariaLa angioplastia primaria es el tratamiento de reperfusión recomendado, por encima de la fibrinolisis, si se realiza por un equipo experimentado dentro de los primeros 120 min desde el primer contacto médico I A 69,99 La angioplastia primaria está indicada en pacientes con insuficiencia cardiaca aguda grave o shock cardiogénico, excepto si el retraso previsto para ICP es excesivo y el paciente se presenta precozmente después del inicio de los síntomas I B 100 Aspectos del procedimiento de la ICP primariaSe recomienda el uso de stent (por encima de angioplastia con balón únicamente) en la ICP primaria I A 101,102 La ICP primaria debe limitarse al vaso responsable, excepto cuando haya shock cardiogénico e isquemia persistente después de la angioplastia primaria de la lesión supuestamente responsable IIa B 75,103–105 Cuando se realice por un operador con experiencia en acceso radial, es preferible el acceso radial al acceso femoral IIa B 78,79 Cuando el paciente no tenga contraindicaciones para TDAP prolongado (indicación de anticoagulación oral o riesgo elevado estimado de hemorragia a largo plazo), y se prevea un alto grado de cumplimiento, son preferibles los stents farmacoactivos a los convencionales IIa A 80,82,106,107 Se debe considerar la aspiración de rutina del trombo IIa B 83–85 No está recomendado el uso rutinario de dispositivos de protección distal. III C 86–108 No está recomendado el uso rutinario de balón de contrapulsación (en pacientes sin shock) III A 97,98ICP: intervención coronaria percutánea; TDAP: tratamiento de doble antiagregación plaquetaria. aClase de recomendación. bNivel de evidencia. Debido a la necesidad de usar antitrombosis potente y fármacos antiplaquetarios, las hemorragias son mucho más frecuentes cuando la angioplastia se realiza durante un SCA (y, en particular, en el IAMCEST), comparado con la hemorragia que ocurre durante un procedimiento electivo. El uso de fármacos con un efecto antitrombótico más potente se acompaña, a menudo, de un aumento en el riesgo hemorrágico relacionado, sobre todo, con el lugar de la punción arterial. Se ha demostrado que el acceso radial reduce la incidencia de episodios hemorrágicos agudos, especialmente en los síndromes coronarios agudos; en el estudio clínico RIVAL para la intervención coronaria, el acceso radial en lugar del femoral redujo la mortalidad en el subgrupo de pacientes con IAMCEST78. Unos hallazgos similares se observaron en el estudio RIFLE STEACS79. En el estudio RIVAL se produjo, no obstante, una interacción entre el beneficio del acceso radial y la experiencia del operador, lo que sugiere que el beneficio del acceso radial sobre el femoral depende de la experiencia de los operadores en utilizar la vía radial. En la angioplastia primaria, los stents farmacoactivos (SFA) reducen el riesgo de revascularización repetida del vaso diana, en comparación con los stents convencionales80. Ha habido cierta preocupación sobre el aumento de riesgo de trombosis intra-stent tardía y reinfarto asociados al uso de SFA, comparado con los stents convencionales80. Sin embargo, el uso de SFA no se ha asociado a un aumento del riesgo de muerte, infarto de miocardio o trombosis intra-stent en el seguimiento a largo plazo82. Un aspecto relacionado con el uso rutinario de SFA en este contexto es que, a menudo, es difícil determinar de forma fiable la capacidad de los pacientes para cumplir o tolerar la doble antiagregación plaquetaria. Un problema asociado con el uso de SFA, de forma rutinaria, en este contexto es que muchas veces es difícil determinar de forma fiable la capacidad de los pacientes para cumplir o tolerar durante un tiempo prolongado la doble antiagregación plaquetaria. Actualmente se está probando si las nuevas generaciones de SFA proporcionan mejores resultados clínicos —comparadas con las generaciones más antiguas o con los stents convencionales— tras una angioplastia primaria. Un único estudio clínico aleatorizado, el TAPAS83, ha demostrado mejores índices de reperfusión miocárdica (resolución del segmento ST y blush miocárdico) a partir del uso rutinario de aspiración manual del trombo antes de introducir un balón o un stent en la arteria coronaria. El seguimiento a 1 año en este estudio ha demostrado una reducción en la mortalidad, con la aspiración del trombo como objetivo secundario84. Se han obtenido resultados similares a partir de un metaanálisis del estudio TAPAS y varios estudios clínicos de menor tamaño85. No se han podido encontrar beneficios similares con la trombectomía mecánica o los dispositivos de protección embólica. No obstante sigue sin conocerse cuál es la diferencia en el impacto clínico entre los distintos modelos86. En el reciente estudio clínico aleatorizado INFUSE-AMI,, la aspiración del trombo no afectó al tamaño de infarto87. Se han iniciado diversos estudios clínicos aleatorizados de gran tamaño para intentar confirmar los resultados del estudio TAPAS88,89. Los operadores que realizan la angioplastia primaria en el contexto del IAMCEST deben ser conscientes de la importancia de seleccionar un tamaño adecuado de stent. La mayoría de los pacientes con IAMCEST tiene algún grado de espasmo coronario y, por lo tanto, la administración intracoronaria de nitratos está recomendad antes de iniciar la secuencia angiográfica coronaria utilizada para la selección del tamaño de stent. La presencia de un trombo también puede llevar a utilizar un stent demasiado pequeño (que se despliega de forma subóptima), que es una causa frecuente de reestenosis o trombosis intra-stent en la práctica diaria. Los estudios clínicos preliminares han explorado el valor del pre y poscondicionamiento miocárdico para mejorar el miocardio salvado. Un pequeño estudio aleatorizado ha probado el efecto del condicionamiento a distancia utilizando isquemia intermitente en el brazo mediante 4 ciclos sucesivos de 5min de duración de inflación y deflación de un manguito de presión arterial90. Este procedimiento se asoció a una mejoría en los marcadores subrogados de rescate miocárdico medidos por imagen de perfusión miocárdica a los 30 días. Se desconoce si este efecto se asocia a beneficios clínicos. El papel del poscondicionamiento se ha explorado en estudios pequeños, ya sea utilizando inflaciones repetidas del balón o perfusiones de ciclosporina. Los resultados son controvertidos91–95. Debido a que estos hallazgos son preliminares y al pequeño tamaño de los estudios clínicos que los han probado, es necesario confirmar el beneficio clínico del pre y poscondicionamiento miocárdico a partir de los estudios clínicos aleatorizados que están en marcha y antes de que estos procedimientos puedan recomendarse en la práctica clínica de rutina. El estudio CRISP AMI no ha demostrado ningún beneficio con el uso rutinario del balón de contrapulsación aórtico (BCPA) en el infarto de miocardio anterior sin shock97 y sí un aumento de la hemorragia, lo que es consistente con los datos disponibles acerca del papel de la BCPA en pacientes con IAM sin shock cardiogénico98. Farmacoterapia periprocedimiento (tabla 12)Los pacientes que se someten a una angioplastia primaria deben recibir una combinación de doble antiagregación plaquetaria con aspirina y un antagonista del receptor de adenosina difosfato (ADP) lo antes posible, antes de la angiografía, y un anticoagulante parenteral. Hasta la fecha, no hay estudios clínicos que hayan evaluado el inicio de la doble antiagregación plaquetaria antes del ingreso hospitalario, en lugar de su administración en el hospital, ni su uso previo, en lugar de su uso durante la angiografía, en el contexto del IAMCEST, pero es una práctica común en Europa y es consistente con los datos farmacocinéticos de los antitrombóticos orales, que sugieren que la administración más precoz es preferible para alcanzar su eficacia de forma más rápida. Tabla 12.Medicación antitrombótica periprocedimiento en la angioplastia primaria Recomendaciones Clasea Nivelb Referencias Tratamiento antiplaquetarioSe recomienda aspirina por vía oral o i.v. (si no se puede deglutir) I B 133,134 Se recomienda un inhibidor del receptor de ADP además de la aspirina. Las opciones son: I A 135,136 • Prasugrel en pacientes que no han tomado clopidogrel, si no hay historia previa de accidente cerebrovascular/AIT, edad I B 109 • Ticagrelor I B 110 • Clopidogrel, preferiblemente cuando el prasugrel o ticagrelor no estén disponibles o estén contraindicados I C – Los inhibidores GP IIb/IIIa se deben considerar para tratamiento de rescate si hay evidencia angiográfica de trombo masivo, flujo lento o no-reflujo o complicación trombótica IIa C – Se puede considerar el uso rutinario de un inhibidor GP IIb/IIIa como tratamiento coadyuvante a la ICP primaria realizada con HNF en pacientes sin contraindicaciones IIb B 137–141 Se puede considerar el uso de un inhibidor GP IIb/IIIa previo al procedimiento (frente al uso en el laboratorio de hemodinámica) en pacientes de alto riesgo que se transfieren a angioplastia primaria IIb B 127,128,137,142 Las opciones para los inhibidores GP IIb/IIIa son (con el nivel de evidencia para cada fármaco): – • Abciximab A 137 • Eptifibatida (con un bolo doble) B 138,139 • Tirofibán (con un bolo de dosis alta) B 140,141 AnticoagulantesSe debe utilizar un anticoagulante inyectable en la ICP primaria I C Se recomienda el uso de bivalirudina (restringiendo el uso de inhibidores GP IIb/IIIa a los tratamientos de rescate) con preferencia al uso de HNF o de un inhibidor GP IIb/IIIa I B 124 Se prefiere el uso de enoxaparina (con o sin inhibidor GP IIb/IIIa de rutina) a la HNF IIb B 122 Se debe administrar HNF, con o sin uso rutinario de un inhibidor GP IIb/IIIa, en pacientes que no reciben bivalirudina o enoxaparina I C 1 No está recomendado el uso de fondaparinux en la angioplastia primaria III B 118 No está recomendado el uso de fibrinolisis antes de una ICP primaria programada III A 127,143ADP: adenosina bifosfato; AIT: accidente isquémico transitorio; GP: glucoproteína; HNF: heparina no fracionada; i.v.: intravenoso; ICP: intervención coronaria percutánea. aClase de recomendación. bNivel de evidencia. La aspirina debe administrarse preferiblemente por vía oral (recomendable una dosis de 150-300 mg), incluso en comprimidos masticables, para asegurar una inhibición completa de la agregación plaquetaria dependiente de tromboxano A2, pero puede administrarse por vía i.v. en pacientes que no pueden deglutir. Hay muy pocosdatos clínicos sobre la dosis i.v. óptima, aunque los datos farmacológicos sugieren que una dosis menor que la que se administra oralmente puede evitar la inhibición de la prostaciclina, por lo que es preferible un bolo de aspirina i.v. en el rango de dosis 80-150mg. Los antagonistas del receptor de ADP preferidos son el prasugrel (dosis de carga de 60mg por vía oral, dosis de mantenimiento de 10 mg) o el ticagrelor (dosis de carga de 180mg por vía oral dosis de mantenimiento de 90mg —2 veces al día—); estos fármacos tienen un inicio de acción más rápido y mayor potencia, y han demostrado ser superiores al clopidogrel en los estudios clínicos de gran tamaño109,110. En el estudio TRITON-TIMI38, el prasugrel redujo la variable principal combinada de muerte cardiovascular, IAM no fatal o accidente cerebrovascular en pacientes que no habían tomado clopidogrel y que se sometían a angioplastia primaria, o angioplastia primaria o secundaria en el contexto del IAMCEST o del SCA sin elevación del segmento ST de riesgo moderado a alto una vez que se había realizado la angiografía coronaria109. En la cohorte entera se produjo un aumento significativo en la tasa de hemorragia mayor TIMI no relacionada con la cirugía coronaria. En el subgrupo de pacientes con IAMCEST que se sometían a angioplastia primaria o secundaria, el beneficio fue consistente, sin que se produjera un aumento significativo del riesgo hemorrágico no relacionado con la cirugía111. El prasugrel está contraindicado en pacientes con accidente cerebrovascular/accidente isquémico transitorio previo. Generalmente, su uso no está recomendado en pacientes ≥ 75 años de edad o en pacientes con bajo peso corporal ( mg, aunque no hay datos disponibles sobre los resultados clínicos con esta dosis y hay antagonistas alternativos del receptor de ADP en este contexto112. En el estudio PLATO, el ticagrelor redujo la variable principal combinada (muerte cardiovascular, IAM no fatal o accidente cerebrovascular) y también redujo la mortalidad cardiovascular en pacientes que no habían tomado clopidogrel o en pacientes pretratados con IAMCEST (programados para angioplastia primaria) o con SCA sin elevación del segmento ST de riesgo moderado a alto (programados para recibir manejo conservador o invasivo)109,110. Aunque no hubo diferencias significativas en las tasas globales de hemorragia mayor definidas en el estudio PLATO entre los grupos de clopidogrel y ticagrelor, las hemorragias mayores no relacionadas con la cirugía coronaria definidas en el estudio PLATO y las hemorragias mayores TIMI estuvieron aumentadas en el grupo de ticagrelor. En el subgrupo de pacientes con IAMCEST, el beneficio fue consistente113. El ticagrelor puede causar disnea transitoria al inicio del tratamiento, que no se asocia a anomalías pulmonares morfológicas o funcionales y que raramente conduce a la interrupción del tratamiento114. En el estudio PLATO, los pacientes que experimentaron disnea presentaron un beneficio sobre la mortalidad con ticagrelor consistente con el observado en el conjunto de la población incluida en el estudio. El ticagrelor también puede asociarse a bradicardia asintomática en la primera semana de tratamiento. Ninguno de los fármacos más potentes (prasugrel o ticagrelor) debe usarse en pacientes con accidente cerebrovascular hemorrágico previo o en pacientes con enfermedad hepática de moderada a grave. Cuando ninguno de estos fármacos esté disponible (o si están contraindicados) se puede administrar en su lugar clopidogrel 600mg p.o.115. El clopidogrel no se ha evaluado frente a placebo en ningún estudio clínico de gran tamaño en el contexto de la angioplastia primaria, pero el régimen de mayor dosis consistente en 600mg dosis de carga/150mg dosis de mantenimiento en la primera semana ha demostrado ser superior al régimen 300/75mg en el subgrupo de pacientes que se sometieron a angioplastia primaria del estudio OASIS 7115, y el uso de una dosis de carga elevada de clopidogrel ha demostrado alcanzar una inhibición más rápida del receptor de ADP. Esto es consistente con la farmacocinética del clopidogrel, un profármaco que requiere un metabolismo importante antes de convertirse en su forma activa y, por lo tanto, que debe administrarse a altas dosis y lo más precozmente posible para ejercer su acción en el contexto de urgencia de la angioplastia primaria. Además, en los estudios observacionales se ha demostrado que el pretratamiento con altas dosis de clopidogrel es superior al tratamiento aplicado en el laboratorio de hemodinámica116,117. Todos los antagonistas del receptor de ADP deben usarse con precaución en pacientes con alto riesgo hemorrágico o con anemia significativa.Las opciones de anticoagulación para la angioplastia primaria incluyen heparina no fraccionada (HNF), enoxaparina y bivalirudina. El uso de fondaparinux en el contexto de la angioplastia primaria se ha asociado con daño potencial en el estudio OASIS 6 y, por lo tanto, no está recomendado118. No se han llevado a cabo estudios clínicos controlados por placebo que evalúen el uso de HNF en la angioplastia primaria, aunque hay amplia experiencia con este fármaco. La dosis debe seguir las recomendaciones estándar para angioplastia (es decir, un bolo inicial de 70-10 0 U/kg cuando no esté previsto administrar ningún inhibidor de la glucoproteína [GP] IIb/IIIa o 50-60 U/kg cuando esté previsto utilizar inhibidores GP IIb/IIIa). No hay datos sólidos que recomienden utilizar el tiempo de activación de la coagulación para establecer la dosis o monitorizar la HNF y, si se usa el tiempo de activación de la coagulación, éste no debe retrasar la recanalización de la ARI. Varios estudios no aleatorizados han sugerido que la enoxaparina (0,5 mg/kg i.v. seguida por tratamiento subcutáneo) proporciona más beneficio que la HNF en la angioplastia primaria119–121. Se ha comparado la enoxaparina con la HNF en un estudio clínico no ciego, el estudio ATOLL. La variable principal combinada formada por muerte a los 30 días, complicación del infarto de miocardio, fallo en el procedimiento y hemorragias mayores no se redujo significativamente (un 17% de reducción; p = 0,063), pero hubo reducciones en la principal variable secundaria combinada de muerte, infarto de miocardio recurrente o SCA, o revascularización urgente, y en variables secundarias combinadas como muerte, o reanimación de paro cardiaco y muerte, o complicación del infarto de miocardio. Es importante señalar que no se describió un aumento de las hemorragias asociadas al uso de enoxaparina respecto a la HNF122. Basándose en estas consideraciones y en la experiencia clínica considerable en el uso de enoxaparina en otros contextos de angioplastia109–111 se prefiere el uso de enoxaparina al de la HNF. Un estudio clínico de gran tamaño no ciego ha demostrado la superioridad de la bivalirudina sobre la combinación de HNF + inhibidor GP IIb/IIIa123, un beneficio que se debió a una reducción marcada en las hemorragias, asociado a un aumento inicial en la trombosis intra-stent, que desapareció después de 30 días124. Es importante remarcar que este estudio describió una reducción en la mortalidad de cualquier causa y mortalidad cardiovascular a los 30 días, que se mantuvo hasta los 3 años82. Una gran proporción de los pacientes del estudio HORIZONS–AMI recibió HNF previamente a la aleatorización, y aproximadamente el 10% recibió inhibidores GP IIb/IIIa como tratamiento de rescate. Este aspecto es importante, ya que la interpretación de los resultados del estudio puede estar ligeramente influida por un elemento de confusión consistente en la interacción entre el uso de HNF prealeatorización, el uso de 600mg de dosis de carga de clopidogrel y el riesgo reducido de trombosis intra-stent125. Diversos estudios clínicos realizados antes del uso rutinario de la doble antiagregación plaquetaria, que utilizaban principalmente abciximab, habían documentado beneficios clínicos de los inhibidores GP IIb/IIIa como tratamiento adyuvante a la angioplastia primaria realizada con HNF126. El estudio FINESSE127 no ha encontrado que el uso rutinario de abciximab antes de la angioplastia primaria produzca beneficios clínicos, sino más bien un aumento del riesgo hemorrágico, si se compara con su uso de rutina en el laboratorio de hemodinámica, lo que sugiere que, en pacientes que se someten a angioplastia primaria, no parece haber ningún beneficio apreciable y sí un aumento del daño al iniciar el tratamiento con inhibidores GP IIb/IIIa en el contexto prehospitalario. Un análisis post-hoc de un subgrupo de pacientes del estudio FINESSE, que se ha centrado en pacientes que se presentaron en las primeras 4 h desde el inicio de los síntomas a hospitales sin capacidad para realizar angioplastias y que requirieron un traslado, ha sugerido que puede haber un beneficio en la supervivencia asociado al uso de abciximab128. Más recientemente, el estudio ON-TIME 2129ha encontrado una mejoría en los marcadores subrogados de reperfusión asociada al tratamiento de tirofibán iniciado durante la fase prehospitalaria, antes de la angioplastia primaria, y que se continuó hasta las 18 h después del procedimiento (comparado con el uso provisional [es decir, no sistemático] en el laboratorio de hemodinámica). También se produjo una reducción de la variable secundaria combinada de muerte durante el infarto de miocardio recurrente en la revascularización urgente del vaso diana y tratamiento antitrombótico de rescate. Finalmente, en el gran estudio clínico HORIZONS-AMI124, no hubo un claro beneficio a partir del uso combinado de un inhibidor GP IIb/IIIa + HNF, comparado con la bivalirudina (con una fracción considerable de pacientes que recibieron HNF antes de la aleatorización), y el estudio Bavarian Reperfusion Alternatives Evaluation-3 no encontró evidencia de una reducción en el tamaño de infarto a partir del tratamiento con abciximab en pacientes sometidos a angioplastia primaria tratados con 600mg de clopidogrel130. Por lo tanto, no hay una respuesta definitiva sobre el papel actual del uso de rutina de los inhibidores GP IIb/IIIa en la angioplastia primaria en la era de la doble antiagregación plaquetaria potente, especialmente cuando se usa prasugrel o ticagrelor, y sigue siendo dudoso el valor de iniciar el tratamiento antes de entrar en el laboratorio de hemodinámica. Parece razonable el uso de inhibidores GP IIb/IIIa como tratamiento de rescate en caso de evidencia angiográfica de trombo de gran tamaño, flujo lento o no reflujo y otras complicaciones trombóticas, pero no se ha demostrado en un estudio aleatorizado. En conclusión, los datos existentes sugieren que si se elige la bivalirudina como anticoagulante, no hay beneficio en la adición de rutina de inhibidores GP IIb/IIIa, y que una estrategia de bivalirudina sola (con un uso provisional de rescate de inhibidores GP IIb/IIIa) produce menores tasas hemorrágicas y reduce la mortalidad. Si se escoge HNF o enoxaparina como anticoagulante sigue siendo controvertido el papel del uso rutinario —en contraposición al uso «de rescate»— de los inhibidores GP IIb/IIIa. La administración intracoronaria (i.c.) de los inhibidores GP IIb/IIIa en lugar de la i.v. se ha probado en varios estudios clínicos pequeños y se ha asociado a algunos b eneficios131. El estudio INFUSE-AMI87ha aleatorizado a 452 pacientes que se sometían a una ICP con bivalirudina a recibir una administración local de abciximab frente a no recibir abciximab. El abciximab i.c. redujo el tamaño de infarto a los 30 días, evaluado por imagen de resonancia magnética, pero no mejoró la puntuación que cuantificaba las anomalías en la motilidad de la pared, la resolución del segmento ST, el flujo coronario postangioplastia o la perfusión miocárdica. El gran estudio clínico aleatorizado Abciximab Intracoronary vs intravenously Drug Application 4, que reclutó a 2.065 pacientes (es decir, más que todos los estudios previos combinados), no encontró ningún beneficio clínico (sino más bien daño) en esta ruta de administración en cuanto a la variable combinada de muerte, reinfarto e insuficiencia cardiaca, y se observó una reducción que estaba en el límite de la significación estadística en la variable secundaria de insuficiencia cardiaca132. Por lo tanto, se puede considerar la ruta i.c., pero la i.v. debe seguir siendo la vía estándar para la administración de los inhibidores GP IIb/IIIa. No está indicado el tratamiento anticoagulante de rutina posprocedimiento tras una angioplastia primaria, excepto cuando haya una indicación independiente para anticoagulación, ya sea a dosis completa (debida, por ejemplo, a fibrilación auricular [FA], válvulas mecánicas o trombo ventricular izquierdo) o a dosis profilácticas para la prevención de la tromboembolia venosa en pacientes que requieran reposo prolongado en la cama. Prevención y tratamiento de la obstrucción microvascular y el no reflujoLa perfusión miocárdica inadecuada después de una apertura mecánica exitosa de la ARI se suele conocer como «no reflujo». El diagnóstico de no reflujo acostumbra a realizarse el flujo TIMI es blush miocárdico sea 0 o 1 o cuando la resolución del segmento ST dentro de las primeras 4 h del procedimiento sea 144. Otras técnicas no invasivas son la ecocardiografía de contraste, la tomografía computarizada por emisión de fotón único. la tomografía por emisión de positrones (PET) y la imagen por resonancia magnética de contraste.Ha habido muchos intentos de tratar el no reflujo mediante vasodilatadores i.c., perfusión i.v. o adenosina o abciximab, pero no hay pruebas definitivas de que estos tratamientos afecten a los resultados clínicos. De forma parecida, y aunque se usa ampliamente en la práctica clínica, no hay evidencias firmes de que la aspiración manual del trombo reduzca la embolización distal83–86,145. |
【本文地址】